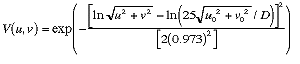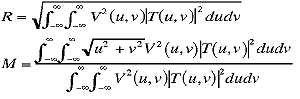1. コンピュータ支援診断 (CAD) とは
コンピュータ支援診断(computer-aided diagnosis, CAD)とはデジタル画像情報の定量化および分析をコンピュータを使って行い、その分析結果を“第2の意見”として画像診断に用いることで、放射線科医の診断を援助することである1-5).CADの一般的アプローチは次の2つに大別される.一つは,胸部画像における結節状陰影の検出に見られるように,病巣のありそうな場所をコンピュータが検出して表示し,見落としが起こらないように注意を喚起する.他の一つは,胸部写真での心胸郭比の計測のように,病巣についての定量的尺度を求めて,読影の際に客観的判断のための情報を提供することである.したがって,CADを用いることで,見落としによる誤診を減少させ,また,主観的判断による思い違いを防止することができれば,画像診断の正確度の向上と,再現性の改善が期待される.このように、CADの目的はコンピュータが放射線科医の役割を置き換えることではなく、放射線科医の読影がやりやすくなるように援助することにある.したがって、CADの基本的思想と方針は、従来から自動診断と呼ばれていたものとは根本的に異なるものであることに注意する必要がある.
放射線画像情報の定量化の最初の試みは、1964年Meyersらによって胸部透視像のデジタル画像から心胸郭比を自動計測することによってなされた6).その後、1970年代からKrugerらを中心として、炭鉱夫塵肺症の重症度を自動分類する研究が数多くなされてきた7,
8).近年、デジタルラジオグラフィーおよび画像処理技術の急速な発展に伴い、CADの分野でも実用化を目的とした新しい研究開発が進められている.現在、世界中の多くの施設でCADに関する研究が行われているが、その対象は胸部単純写真では結節状陰影、間質性肺疾患、心肥大および気胸の検出、乳房画像では微小石灰化9-11)および腫瘤影の検出12-14)、血管造影像では血管狭窄率15)および血流量率の計測16)、骨画像では骨粗鬆症検出を目的とした骨梁パターンの計測17,18)などがある.特にシカゴ大学の土井らは幅広い領域の画像に対するCADシステムの開発に関する優れた研究を数多く行い、1994年には乳房撮影像に対するCADの臨床用“インテリジェント”ワークステーションを試作し現在臨床評価を継続して行っている.彼等は臨床で撮影された乳房画像に対して毎日微小石灰化および腫瘤影検出プログラムを走らせ、これまでに合計約4000症例16000枚の画像を分析している.この中の最初の約1000例の患者群から7症例の異常陰影を検出し、そのすべてがバイオプシーによって乳癌であることが確認されている.また、1画像当たりの平均無病誤診率は微小石灰化が0.9個、腫瘤影が1.4個であったと報告している.この結果は現在の乳房画像に対するCAD技術でも、かなりの程度臨床に役立つことを意味しており、これからのCADの研究に明るい未来を示唆した大変意義深い結果であると思われる.
胸部画像に対するCADは、乳房画像と比較して画像が極端に複雑であることなどの理由から、実用化の研究は一歩遅れている.しかし、日本では肺癌の早期発見を目的とした集団検診が各地で行われているため、胸部画像に対するCADの実用化が強く望まれており、最近では、スパイラルCTを用いた集団検診画像に対する結節状陰影の検出を目的としたCADの研究も行われている.ここでは、胸部単純X線写真における結節状陰影、間質性肺疾患、心肥大および気胸の検出を目的とした、我々が用いているCADの手法の概略とその現状を述べる.
2. ハードウエアシステム構成
CADに用いられる基本的なハードウエアーシステム構成をFig. 1に示す. スクリーン・フィルム系で撮像された放射線画像を、市販のフィルムデジタイザー(例えばコニカ社製LD4500)によってデジタル化する場合、ピクセル寸法は0.05
mmから0.2 mm、階調数は1024(10 bits)から4096 (12 bits)の範囲でデジタル化が可能である.また、写真濃度は0.0から3.0もしくは3.5の範囲をリニアーにデジタル化する場合が多い.一般に、より小さなピクセル寸法、かつ、より大きい階調数でデジタル化すれば、オリジナル像に忠実な画像が得られるが、ディスク容量や演算速度も考慮しなければならない.対象となる疾患の性質によりこれらのパラメータは変化し、乳房撮影像における微小石灰化の検出の場合は、ピクセル寸法が0.05
mm、また、胸部写真の場合にはピクセル寸法が0.2 mmが普通である.したがって、大角サイズの胸部写真をピクセル寸法0.2
mmでデジタル化した場合、8MBの記憶スペースがコンピュータ内部で必要となる.また、イメージングプレートを使ったCR画像を入力画像として使うことももちろん出来るが、オートモードで撮影されたCR画像のピクセル値は、イメージングプレートからの発光量に比例する値に変換しなければ、画像間の相互比較が困難になる場合がある.
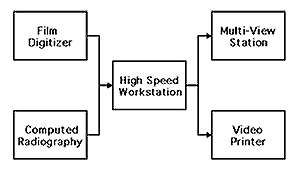
Fig. 1 Schemetic diagram of CAD hardware system.
画像処理および解析のためには高速のコンピュータが必要となる.主メモリーは少なくとも64MB、磁気ディスクの容量は3GB以上が望ましい.通常ワークステーション(例えばSun
Microsystems社Sparc 10など)を使うことが多いが、最近ではパソコンの高性能化、低価格化によって比較的容易にコンピュータ環境が整えられるようになってきた.また、CADの出力結果の表示には複数台のCRTモニターと記録のためのレーザープリンターのあることが望ましい.
3. 結節状陰影の検出
胸部単純写真において、肺腫瘍などに起因する結節状陰影を放射線科医が見落とす確率は約30%近くもあると報告されている19,20).さらに、この見落とされた結節状陰影のほとんどのものは、後日その存在が指摘されると認識できるものであることも分かっている.見落としの原因には多くの因子が含まれるが、基本的には胸部写真を読影する際の放射線科医の”観察者としての特性”、あるいは”人間的エラー”が主要な寄与をしていると考えられる.特に、結節状陰影の周囲にある肋骨や肺血管などの胸部写真に含まれる正常構造が、結節状陰影をカムフラージュ(偽装)してしまうために、結節状陰影が目立たなくなってしまい、その結果見落としが起こりやすくなる.また、明らかな異常を一つ見つけたとき、それ以外の異常陰影を見つけるための読影をやめてしまう場合があることも見落としの原因になっていると言われている.
そこで、胸部写真における結節状陰影の検出に関するCADの目的は、コンピュータが結節状陰影と疑われる位置を自動検出して示し、注意を喚起することにある.最終的には放射線科医が真の結節状陰影か否かを判断するが、注意を喚起されることによって、見落としを減少させることが可能となる.結節状陰影の自動検出には円形パターンの探索が中心技術となるが、ここでは差分像を用いた方法21-24)について概略を説明する(Fig.
2).
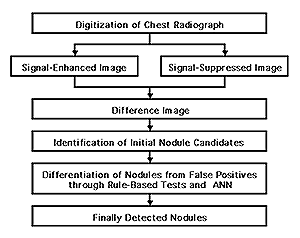
Fig. 2 Overall scheme of lung nodule detection
差分法では、1枚の胸部写真からマッチドフィルターにより結節状陰影のコントラストを増強した画像と、平滑化フィルターによりコントラストを減弱した画像を作り2つの画像間の差分をとる.マッチドフィルターは直径9mmの結節状陰影のコントラスト対雑音比が最大となるように設計されている.このような信号の増強、平滑および差分を組み合わせた周波数空間でのフィルターをFig.
3に示す.差分像では肋骨などの胸部正常構造のコントラストはかなり低下するが、逆に、結節状陰影のコントラストは原画像よりも強調されることになる.このことが可能なのは、像処理によって選択的に信号の増強と減弱という相反する作用が行われる一方、これらの処理画像に含まれる低周波のバックグランド構造がほぼ同等に保たれているからである.
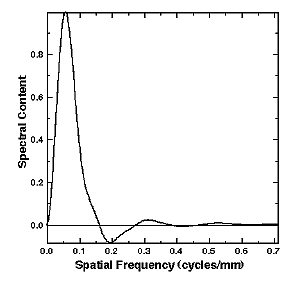
Fig. 3 The difference-image filter in the spatial
frequency domain.
差分像に対する結節状陰影の特徴抽出は、しきい値処理と陰影の幾何学的形状計測が基本となる.まず、Fig.
4に示すように差分像に対して多数回のしきい値処理を行う.ここで、しきい値は差分画像のピクセル値のヒストグラムの面積比率で表現している.すなわち、Fig.
4 (a)は差分像ヒストグラムの上位3%に含まれるピクセル値による像を示している. Fig. 4では矢印をつけた2個が真の結節状陰影であるが、それ以外にも胸郭、肺血管などの陰影がしきい値処理によって描出されている.これらの陰影から結節状候補陰影を絞り込むために、陰影の有効直径、円形度および不整度の変化を調べる.各種の形状パラメータはFig.
5に定義されており、たとえば、円形度は陰影の面積と等しい円(その直径を有効直径という)の中心を、陰影の中心に置いたときの、陰影と円の重なった面積の比率によって定義される.Fig.
6およびFig. 7に結節状陰影および血管影に対する各しきい値の有効直径と円形度の変化をそれぞれ示す.結節状陰影はしきい値の増大とともに有効直径は緩やかに変化し、また、比較的高い円形度を保持しているのに対し、血管影はしきい値16%(遷移点)で急激な有効直径の増加と円形度の低下が見られる.このように陰影の幾何学的形状をモニターすることで結節状候補陰影を絞り込むことができる.実際には、このようなモニターを差分画像のみならず原画像に対しても行っており、最終的に、多数の真の結節状陰影でトレーニングされたニューラルネットワークを使って候補陰影をさらに絞り込んでいる.
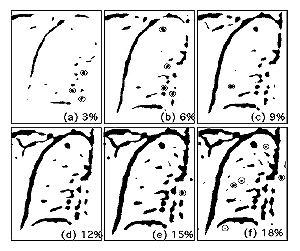
Fig. 4 Illustration of the multiple-level thresholding
for a difference image. Circles and arrows indicate
candidates and true nodules, respectively. All candidates
of non-nodules in this case were removed by the
rule-based method and the neural networks.
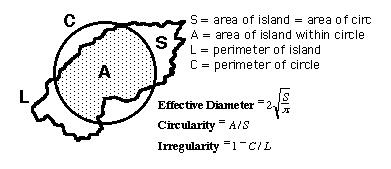
Fig. 5 The definition of effective diameter,
circularity and irregularity for an island.
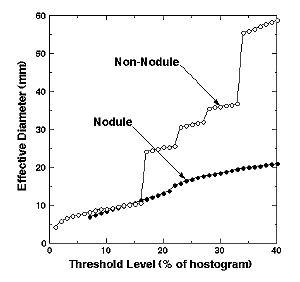
Fig. 6 Dependence of the effective diameter
on the threshold levelfor a nodule and a non-nodule
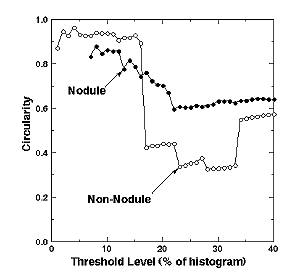
Fig. 7 Dependence of the circularity on the
threshold levelfor a nodule and a non-nodule.
自動検出された結節状陰影は、CRTモニター上の胸部像に重ねて表示される.この手法を100例の正常胸部写真、および、CTで確認された直径5ー30mmの結節状陰影100例、合計200例の胸部写真に適用した結果は、有病正診率が約75%、無病誤診率は約1.0(個/画像)であった.
4. 間質性肺疾患の検出
胸部単純写真における間質性肺疾患の診断は、放射線画像診断のなかでは最も困難な問題の一つといわれている.その理由は間質性浸潤影のコントラストがきわめて低く、そのパターンが複雑であることと、さらに、それらのパターンの記述と名称が、粒状影とか網状影などと、主観的なものであり、客観的に定義されていないことなどである25,26).そこで、もし肺野テクスチャー
(texture) パターンを客観的に定量化できるような方法があれば、主観性が減少し、画像診断の正確さおよび再現性が改善されることが期待される.したがって、間質性肺疾患の検出に関するCADの目的は、間質性浸潤影の特徴を定量的尺度(テクスチャー尺度)で表現し、これを放射線科医の画像診断のための客観的材料として提供することである.
浸潤影の特徴量の選択には,間質性肺疾患を持った異常肺を高感度で検出できる特徴量を選択することが最も重要であるが,その特徴量が人間の視覚で理解できることも,CADの実用化には極めて大切である.なぜなら,放射線科医の診断結果とコンピュータの解析結果に矛盾が生じた場合,理解不可能な特徴量を使っておれば,矛盾の原因究明が困難になるからである.特徴量を求めるためのテクスチャー解析の手法としては,写真濃度ヒストグラム,同時生起行列,差分統計量,ランレングス行列,パワースペクトルを用いる方法などが使われている.ここでは肺野テクスチャーパターンのパワースペクトルから求めたテクスチャー尺度を用いて、間質性肺疾患の検出を行う手法(Fig.
8)について述べる27-40).
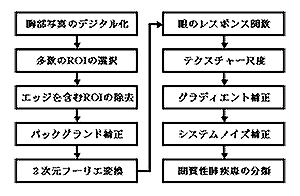
Fig. 8 Overall scheme of lung texture analysis
for detection and characterizatiomn of interstitial
disease.
まず、解析の対象となる1辺 約6 mmの正方形関心領域 (region of interest,
ROI) を、両肺野の外側に出来るだけ数多く設定する.しかし、肋骨の鋭いエッジを含んだROIは、肋間や肋骨と重なるROIとは明らかに異なるtextureを有するので、濃度勾配のヒストグラムの均一性を分析することにより除外する.すなわち、肋骨エッジを含むROIの濃度勾配ヒストグラムは、肋骨の走行方向に偏るために均一性が低下するが、肋骨エッジを含まないROIの濃度勾配ヒストグラムの均一性は高くなる.次に、残された約300個のROIに対してバックグランド補正を行う.一般に、肺野の濃度変化は肺、胸壁の構造による大まかな濃度変化(バックグランド)、および間質性浸潤影に関係のある微細なテクスチャーに原因する濃度変化から成り立っている.したがって、間質性肺疾患を感度良く検出するためには、肺野全体の濃度変化から微細変動成分だけを抽出するバックグランド補正が必要となる.バックグランド補正は、大まかな濃度変化を最小二乗法を使って2次元面関数近似で得られるバックグランドを、全体の濃度変化から差し引くことで行う.さらに、バックグランド補正されたROIの2次元フーリエ変換から求まるパワースペクトルを眼のレスポンス関数41)、V(u,
v)、を用いてフィルタリングする. 眼のレスポンス関数は次式で求められ、胸部写真に含まれる高周波の放射線モトルと、低周波の残留バックグランド成分を抑制するバンドパスフィルターである.
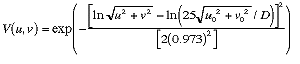
ここで、u0とv0は観察距離Dを25cmとしたとき、V(u, v)が最大となる空間周波数である.Fig.
9に1.5 cycles/mmで最大となるような眼のレスポンス関数を示す.また、正常肺と間質性肺疾患を持つ異常肺から選択したROIに対するフィルター後のパワースペクトルをFig.
10に示した.
Fig. 9 Visual system response of the human observer

Fig. 10 Filtered power spectra of normal lung
(left side) and abnormal lung (right side)
最後に、フィルタリングされたパワースペクトルから、テクスチャー尺度としてrms変動値 (root
mean square variation) 、R、および1次モーメント、M、が決定される.RとMはそれぞれ次式で表わされ、肺野テクスチャーの濃度変動の大きさと粗さ(または細かさ)を表現する量である.
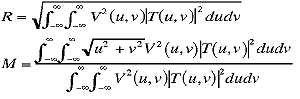
ここで,T(u, v)は肺野テクスチャーのフーリエ変換である.
テクスチャー解析から得られた2つの尺度は,次に述べる方法を用いて正常肺と間質性肺疾患を持った異常肺に自動分類するために使用される.まず,2つのテクスチャー尺度は,データベースに含まれる多数の正常肺から求められたテクスチャー尺度の平均値と標準偏差を用いて正規化される.次に,正規化された2つのテクスチャー尺度と,正常肺の平均のテクスチャー尺度間の距離と対応する単一尺度を求め,それがしきい値を超えるものを異常ROIとして選び出す.最後に,選択された異常ROIの個数が肺野全体のROI
の20%以上であれば,異常肺として分類される.自動分類の結果はCRT上の胸部像に重ねたシンボルで表わされる.十字、円、四角および六角形のシンボルは、それぞれ正常、粒状、網状および網粒状陰影に対応し、シンボルの大きさは重症度を表わしている.シンボルの種類とサイズは個々のROIのテクスチャー尺度とデータベースとの比較によって決定している.本法をデータベースに含まれる100例の正常肺と100例の間質性肺疾患を持った異常肺について適用した結果、有病正診率95%、無病正診率95%であった.
5. 心臓および肺野の形状計測
心肥大を胸部単純写真で読影する場合、明らかな心肥大は容易に検出できるが、わずかな心臓の大きさの変化は肉眼では検出が困難である.したがって、胸部単純写真における心肥大の客観的判断基準として、心胸郭比の計測が広く行われてきた.このような理由から、心臓の大きさの自動計測は最も古くから始められた医用画像処理における研究テーマであった.心臓の形状計測においては、いかにして心臓の辺縁を正確に検出するかが重要な技術であり、ここではモデル関数を用いる方法を概説する42,
43).
心臓全体を含む長方形ROIを、胸部写真の垂直および水平方向のsignature(ある幅をもった直線上での加算されたピクセル値の分布)を用いて設定する.このROI内で左右肺野と心陰影の境界および横隔膜辺縁を1次微分の大きさと方向を分析しながら検出する.このとき、心臓の上端と下端の境界は写真上に描出されてないことが多いので、検出された左右の境界点データについてモデル関数を用いて近似し、心臓全体の辺縁を描出する.近似に用いたモデル関数の決定は次のようにして行った.心陰影の形状が異なる12例の胸部写真を選び、4人の経験豊富な放射線科医がそれぞれ自分自身の主観的判断に基づいて心臓の境界をトレースする.これらのトレースは心臓の左右端の境界では良く一致するが、上下の境界ではかなりの変動がある.次に、4人の平均のトレースを求め、その閉曲線の中心を基準とする極座標を使った周波数解析で、放射線科医がトレースした心臓の形を分析した.その結果、変形した楕円で近似するのが最も誤差が小さくなることが分かったため、結局、モデル関数として以下に示すような振幅と位相が同時に変化する余弦関数を使用した.
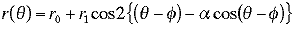
ここで r(θ) は極座標で角度θのときの中心から心陰影境界までの距離を示し、r0, r1,
α およびφはパラメータである. このような心臓境界の自動検出を46例の胸部写真に対して行い、その結果を放射線科医が主観的に評価したところ、ほとんどすべてが良好であるという結果が得られている.
一方、肺野および胸郭の境界も水平方向のsignatureと微分演算子を用いて検出され、Fig.
11に示す各部のパラメータが計測される.これらの中で、放射線科医がマニュアルで求めた心胸郭比と、コンピュータが自動計測した心胸郭比の間には、相関係数0.91の強い正の相関があることが分かり、コンピュータの自動計測はマニュアル法と良い一致を示している.
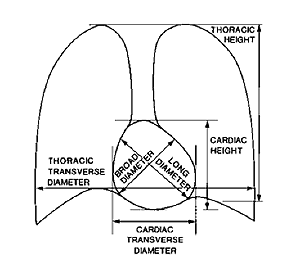
Fig. 11 Size parameters for the heart and lungs
6. 気胸の検出
気胸は胸部単純写真において重要な異常陰影であるが、しばしば肋骨あるいは鎖骨との重なりのために診断が困難となることがある.気胸の画像上の特徴的陰影は胸郭に沿った曲線であるから、気胸の自動検出には細い滑らかな曲線の検出技術が必要である.まず、気胸の出現頻度の高い上肺野にROIを設け、その中で微分演算子から求めた濃度勾配の方向が、胸郭外側の形状から予測した方向と同じ方向をもつ画素のみを選択的に強調する.ROIの中に含まれる肋骨のエッジは別に検出して除外し、最終的に気胸による微細な曲線がHough変換によって検出される.Hough変換とは直線、円、楕円、放物線などパラメータで記述できる図形を画像中から検出するための手法である.この方法を60例の胸部写真に適用した結果は、有病正診率約80%、無病正診率約70%と報告されている44).
7. おわりに
ここで述べた胸部単純X線写真における結節状陰影、間質性肺疾患、心肥大および気胸の自動検出の現状をTable
1に示す. Tableに示した計算時間はハードウエアーの進歩にともない、確実に短縮されることが期待される.しかし、
これらの検出能は臨床例から選択された正常例と異常例をほぼ同数含んでいるデータベースに対して適応した結果であることに注意する必要がある.実際の臨床現場における異常例の存在確率はこれよりもはるかに少なく、その様な環境に対しての検出能を求めることが重要であるが、そのためには胸部CADの臨床用“インテリジェント”ワークステーションを試作し、連続的かつ長期に亘っての評価を行わなければならない.
現在進められている病院間の画像通信ネットワークなどの進展と相俟って、このような大規模データベースは構築しやすくなっており、胸部CADの今後の大きな発展が予想される.
Table 1 Current levels of performances of chest CAD
schemes.
| |
Sensitivity(%) |
Specificity(%) |
CPU Time(sec) |
| Lung Nodule |
75 |
1.0/image * |
25.0 |
| Interstitial Disease |
95 |
95 |
0.3 |
| Cardiomegaly |
90 |
90 |
0.3 |
| Pneumothorax |
80 |
70 |
17.0 |
*number of false positives
|
【参考文献】
- K. Doi, M. L. Giger, H. MacMahon, et al. : Development
of automated schemes for quantitative analysis
of radiographic images. Seminars in Ultrasound,
CT and MRI 13 : 140-152, 1992.
- M. L. Giger, K. Doi, H. MacMahon, et al. : An
intelligent workstation for computer-aided diagnosis.
RadioGraphics 13 : 647-656, 1993.
- H. MacMahon, K. Doi, H.P. Chan, et al. : Computer-aided
diagnosis in chest radiology. J. Thorac. Imag.
5 : 67-76, 1990.
- K. Doi, M. L. Giger, H. MacMahon, et al. : Computer-aided diagnosis: present and future. A new horizon on
medical physics and biomedical engineering. ed.
by H. Abe, K. Atsumi, T. Iinuma, M. Saito and
M. Inoue, Elsevier Science Publishers B.V. , Amsterdam,
59-66, 1991.
- 土井邦雄,桂川茂彦,M. L. Giger、他:ディジタルラジオグラフィにおけるコンピュータ支援診断の可能性.
日放技会誌 45 : 653-663, 1989.
- P. H. Meyers, C. M. Nice, H. C. Becker, et al:
Automated computer analysis of radiographic images.
Radiology, 83 : 1029-1033, 1964.
- R. P. Kruger, W. B. Thompson, A. F. Turner :
Computer diagnosis of pneumoconiosis. IEEE Trans.
Syst. Man and Cybern., 4 : 40-49, 1974.
- J. R. Jagoe : Gradient pattern coding : An application
to the measurement of pneumoconiosis in chest
X rays. Comput. Biomed. Res., 12 : 1-15, 1979.
- H. P. Chan, K. Doi, et al. : Image feature analysis
and computer-aided diagnosis in digital radiography
: 1. Automated detection of microcalcifications
in mammography. Med. Phys., 14: 538 - 548, 1987.
- H. P. Chan, K. Doi, et al.: Computer - aided
detection of microcalcifications in mammograms
: Methodology and preliminary clinical study.
Invest. Radiol., 23: 664 - 671, 1988.
- H. P. Chan, K. Doi, et al.: Improvement in radiologists′detection
of clustered microcalcifications on mammograms
: The potential of computer - aided diagnosis.
Invest. Radiol., 25: 1102 - 1110, 1990.
- M. L. Giger, R. M. Nishikawa, et al. : Development
of a “smart” workstation for use in mammography.
Proc. SPIE, 1445: 101 - 103, 1991.
- M. L. Giger, F. F. Yin, et al. : Investigation
of methods for the computerized detection and
analysis of mammographic masses. Proc. SPIE, 1233:
183 - 184, 1990.
- F. F. Yin, M. L. Giger, et al. : Computerized
detection of masses in digital mammograms : Analysis
of bilateral - subtraction images. Med. Phys.,
18: 955 - 963, 1991.
- K. R. Hoffmann, K. Doi, et al. : Automated tracking
and computer reproduction of vessels in DSA images.
Invest. Radiol., 25: 1069 - 1075, 1990.
- K. R. Hoffmann, K. Doi, et al.: Determination
of instantaneous and average blood flow rates
from digital angiograms using distance - density
curves. Invest. Radiol., 26: 207 - 212, 1991.
- P. Caligiuri, M. L. Giger, M. Favus, et al :
Computerized radiographic analysis of osteoporosis.
Radiology 186 : 471-474, 1993.
- P. Caligiuri, M. L. Giger, M. Favus, et al :Multifractal
radiographic analysis of osteoporosis. Med. Phys.
21 : 503-508, 1994.
- L. W. Guiss, P. Kuenstler : A retrospective
view of survey photofluorograms of persons with
lung cancer. Cancer 13 : 91-95, 1960.
- J. V. Forrest, P. J. Friedman : Radiologic errors
in patients with lung cancer. West J. Med. 134
: 485-490, 1981.
- M. L. Giger, K. Doi, et al. : Image feature
analysis and comuter - aided diagnosis in digital
radiography : 3. Automated detection of nodules
in peripheral lung fields. Med. Phys., 15: 158
- 166, 1988.
- M. L. Giger, K. Doi, et al.: Computer - aided
detection of pulmonary nodules in digital chest
images. Radiographics, 10: 41 - 52, 1990.
- M. L. Giger, N. Ahn, et al. : Computerized detection
of pulmonary nodules in digital chest images :
Use of morphological filters in reducing false
- positive detections. Med. Phys., 17, 861 -865,
1990.
- H. Yoshimura, M. L. Giger, et al. : Computerized
scheme for the detection of pulmonary nodules:
Nonlinear filtering technique. Invest. Radiol.,
27: 124 - 129, 1992.
- G. P. Genereux : Pattern recognition in diffuse
lung disease. Med. Radiogr. Photogr., 61 : 2-31,
1985.
- R. G. Fraser, J. A. P. Pare : Diagnosis of diseases
of the chest. 423-431, 1970, Saunders, Philadelphia.
- S. Katsuragawa, K. Doi, H. MacMahon : Image
feature analysis and computer-aided diagnosis
in digital radiography : Detection and characterization
of interstitial lung disease in digital chest
radiographs. Med. Phys. 15 : 311-319, 1988.
- G. F. Powell, K. Doi, S. Katsuragawa : Localization
of inter-rib spaces for lung texture analysis
and computer-aided diagnosis in digital chest
images. Med. Phys. 15: 581-587, 1988.
- S. Katsuragawa, K. Doi, H. MacMahon : Image
feature analysis and computer-aided diagnosis
in digital radiography : Classification of normal
and abnormal lungs with interstitial disease in
chest images. Med. Phys. 16 : 38-44, 1989.
- S. Katsuragawa, K. Doi, N. Nakamori, et al.:
Image feature analysis and computer-aided diagnosis
in digital radiography : Effect of digital parameters
on the accuracy of computerized analysis of interstitial
disease in digital chest radiographs. Med. Phys.
17 : 72-78, 1990.
- S. Katsuragawa, K. Doi, H. MacMahon, et al.:
Quantitative computer-aided analysis of lung texture
in chest radiographs. RadioGraphics 10 : 257-269,
1990.
- 桂川茂彦,土井邦雄,H. MacMahon, 他:間質性肺疾患のコンピュータ支援診断の可能性. 日本医放会誌 50
: 753-766, 1990.
- 佐々木康夫,桂川茂彦,柳澤融:じん肺標準写真のテクスチャー解析による定量的評価. 日本医放会誌 52
: 1385-1393, 1992.
- 桂川茂彦, 阿部克巳,柳澤融、他:コンピュータ支援診断とPACSへの応用. 放医物理 13:33-45,
1993.
- 桂川茂彦:コンピュータ支援診断システムにおける画像処理技術.日放技会誌 49 : 833-839,
1993.
- X. Chen, K. Doi, S. Katsuragawa, et al.: Automated
selection of regions of interest for quantitative
analysis of lung textures in digital chest radiographs.
Med. Phys. 20: 975-982, 1993
- K. Abe, K. Doi, H. MacMahon, et al. : Analysis
of results in a large clinical series of computer-aided
diagnosis in chest radiography. Radiologia diagnostica
35 : 9-14, 1994.
- 桂川茂彦、杜下淳次:胸部疾患におけるCAD. 放医物理 15 : 113-121, 1995.
- L. Monnier-Cholley, H. MacMahon, S. Katsuragawa,
et al. : Computerized analysis of interstitial
infiltrates on chest radiographs: A new scheme
based on geometric pattern features and Fourier
analysis. Academic Radiol. 2 : 455-462, 1995.
- J. Morishita, K. Doi, S. Katsuragawa, et al.
: Computer-aided diagnosis for interstitial infiltrates
in chest radiographs: Analysis of optical-density
dependence on texture measures. Med. Phys. 22
: 1515-1522, 1995.
- H. P. Chan, C. E. Metz, et al. : Digital image
processing: Optimal spatial filter for maximization
of the perceived SNR based on a statistical decision
theory model for the human observer. Proc. SPIE
535 : 2-11, 1985.
- N. Nakamori, K. Doi, et al. : Image feature
analysis and computer - aided diagnosis in digital
radiography : Automated analysis of sizes of heart
and lung in digital chest images. Med. Phys.,
17: 342 - 350, 1990.
- N. Nakamori, K. Doi, et al.: Effect of heart
size parameters computed from digital chest radiographs
on detection of cardiomegaly : Potential usefulness
for computer - aided diagnosis. Invest. Radiol.,
26: 546 - 550, 1991.
- S. Sanada, K. Doi, et al. : Image feature analysis
and computer - aided diagnosis in digital radiograpy
: Automated detection of pneumothorax in chest
images. Med. Phys., 19: 1153 - 1160, 1992
|